里程碑|宇耀生物首個(gè)創(chuàng)新藥臨床(IND)獲批
2022年3月3日,宇耀生物自主研發(fā)的新一代EP4受體小分子拮抗劑YY001臨床試驗(yàn)申請(qǐng)正式獲得國(guó)家藥品監(jiān)督管理局(NMPA)批準(zhǔn),同意針對(duì)晚期實(shí)體腫瘤開展1期臨床試驗(yàn)。這是宇耀生物獲得的中國(guó)首個(gè)IND批件,該靶點(diǎn)全球尚無(wú)同類藥物上市,其1期臨床即將在上海市東方醫(yī)院開展。
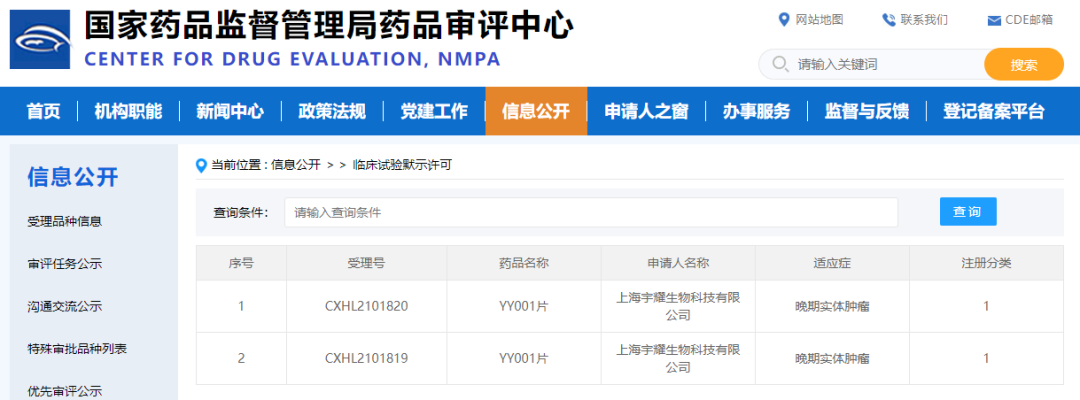

YY001是宇耀生物自主研發(fā)的新一代EP4受體小分子拮抗劑,也是國(guó)內(nèi)首個(gè)自主原研高選擇性EP4受體拮抗劑。相較處于臨床試驗(yàn)各階段的競(jìng)品,其臨床前研究數(shù)據(jù)顯示,靶點(diǎn)活性提高了5-10倍, 口服生物利用度提高2倍,體內(nèi)血藥濃度提高了4倍,是一個(gè)全方位的全球同類最佳(Best-in-class)產(chǎn)品。
宇耀生物YY001的臨床前藥效研究顯示其在結(jié)直腸癌、胃癌和前列腺癌等晚期實(shí)體腫瘤中表現(xiàn)出顯著的抗腫瘤作用,并且在和PD-1抗體聯(lián)用時(shí)顯著增強(qiáng)治療效果,有望將PD-1抗體治療不敏感的冷腫瘤轉(zhuǎn)變?yōu)闊崮[瘤,為晚期實(shí)體瘤的治療提供新的策略,造福更多的中國(guó)乃至全球晚期癌癥患者[1,2]。
宇耀生物CEO周文波博士表示:
“YY001的提前獲批是公司與CDE監(jiān)管部門充分溝通、協(xié)力合作的結(jié)果,也充分表明了CDE對(duì)公司臨床前數(shù)據(jù)的高度認(rèn)可。YY001是國(guó)內(nèi)原研首個(gè)靶向EP4的新藥臨床批件,目前該靶點(diǎn)尚無(wú)同類藥物上市。宇耀生物作為國(guó)內(nèi)首家獲批的具有全球知識(shí)產(chǎn)權(quán)的臨床批件,填補(bǔ)了該領(lǐng)域國(guó)內(nèi)的空白。YY001的獲批是宇耀生物全球頂尖科學(xué)家與資深工業(yè)化團(tuán)隊(duì)科研成果轉(zhuǎn)化的典范,今年我們還將有多個(gè)中美臨床批件的獲批。”
宇耀生物董事長(zhǎng)劉明耀博士表示:

關(guān)于宇耀
上海宇耀生物科技有限公司由中美頂尖科學(xué)家創(chuàng)建成立,目前已有博士和碩士員工30余名,在閔行區(qū)溫度科技園擁有5000余平的辦公和研發(fā)實(shí)驗(yàn)室。
公司有3大藥物發(fā)現(xiàn)平臺(tái)和8個(gè)在研產(chǎn)品管線針對(duì)發(fā)生率和死亡率前十的肺癌、前列腺癌、胰腺癌和胃腸道腫瘤等進(jìn)行了全方位布局。產(chǎn)品YY001是通過腫瘤免疫治療PD-1不敏感的晚期實(shí)體瘤,即將開展臨床1期實(shí)驗(yàn),是一個(gè)全球最優(yōu)(Best-in-class)的免疫檢查點(diǎn)拮抗劑。產(chǎn)品YY002是全球首創(chuàng)(First-in-class)的轉(zhuǎn)錄因子抑制劑,已經(jīng)在中國(guó)和美國(guó)進(jìn)行IND申報(bào)準(zhǔn)備中,未來其他產(chǎn)品管線也即將陸續(xù)進(jìn)入臨床。公司目前已申請(qǐng)發(fā)明專利13余項(xiàng)和PCT專利4項(xiàng)并成功進(jìn)入歐美、日本等國(guó)家與地區(qū)。
公司先后斬獲第七屆“創(chuàng)青春”中國(guó)青年創(chuàng)新創(chuàng)業(yè)大賽金獎(jiǎng)(上海市唯一)、第六屆“互聯(lián)網(wǎng)+”大學(xué)生創(chuàng)新創(chuàng)業(yè)大賽金獎(jiǎng)以及全國(guó)第一屆博士后創(chuàng)新創(chuàng)業(yè)大賽金獎(jiǎng)等榮譽(yù)。公司團(tuán)隊(duì)和產(chǎn)品也受到眾多專業(yè)投資機(jī)構(gòu)認(rèn)可,目前已經(jīng)獲得5家機(jī)構(gòu)數(shù)千萬(wàn)元天使投資。豐富的產(chǎn)品管線和全球頂尖的新藥研發(fā)團(tuán)隊(duì)有望使公司在未來3-5年登陸資本市場(chǎng),成為一家具有全球競(jìng)爭(zhēng)力的創(chuàng)新藥企業(yè)。
文章來源:宇耀生物


